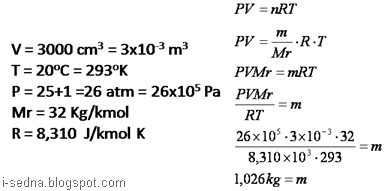Di dalam teori kinetik gas terdapat suatu gas ideal. Gas ideal adalah suatu gas yang memiliki sifat-sifat sebagai berikut :
-
Jumlah partikel gas banyak sekali tetapi tidak ada gaya tarik menarik (interaksi) antar partikel -
Setiap partikel gas selalu bergerak dengan arah sembarang atau bergerak secara acak -
Ukuran partikel gas dapat diabaikan terhadap ukuran ruangan. Atau bisa dikatakan ukuran partikel gas ideal jauh lebih kecil daripada jarak atar partikel -
Bila tumbukan yang terjadi sifatnya lenting sempurna -
Partikel gas terdistribusi merata pada seluruh ruang dengan jumlah yang banyak -
Berlaku hukum Newton tentang gerak
Di dalam kenyataannya, kita tidak menemukan suatu gas yang memenuhi kriteria di atas, akan tetapi sifat itu dapat didekati oleh gas pada temperatur tinggi dan tekanan rendah atau gas pada kondisi jauh di atas titik kritis dalam diagram PT.
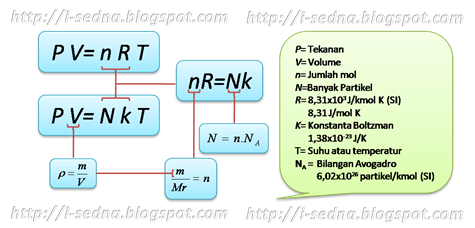
2. Hukum-hukum tentang gas A.Hukum Boyle
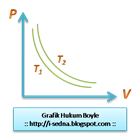 Hasil kali tekanan(P) dan volume(V) gas pada suhu tertentu adalah tetap. Proses seperti ini disebut juga dengan isotermal (temperatur tetap).
Hasil kali tekanan(P) dan volume(V) gas pada suhu tertentu adalah tetap. Proses seperti ini disebut juga dengan isotermal (temperatur tetap). *PV=konstan
*T2>T1
*Tidak berlaku pada uap jenuh
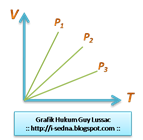 B.Hukum Guy Lussac
B.Hukum Guy Lussac Hasil bagi volume(V) dengan temperatur (T) gas pada tekanan tertentu adalah tetap. Proses ini disebut juga isobarik (tekanan tetap).
*V/T=konstan
*P3>P2>P1

C.Hukum Charles
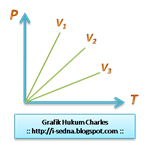
Hasil bagi tekanan (P) dengan temperatur (T) gas pada volume tertentu adalah tetap. Proses seperti ini disebut dengan isokhorik (volume tetap).
*P/T=konstan
*V3>V2>V1

D.Hukum Boyle-Guy Lussac

Hukum Boyle dan Guy Lussac merupakan penggabungan dari hukum Boyle dengan hukum Guy Lussac. Biasanya di dalam soal rumus yang sering digunakan adalah rumus dari hukum ini. Sekedar trik dari saya, anda bisa menamai hukum ini dengan hukum BoLu (Boyle-Lussac). Nah, dari hukum ini kita bisa mendapatkan:
PV/T=konstan
Contoh soal dan pembahasannya:
1. Sebuah bejana berisi gas He yang mempunyai volume 2 L, tekanan 1 atm dan suhunya 27`C. Jika suhunya dinaikkan menjadi 127`C dan ternyata tekanannya naik 2 kalinya. Hitung volume sekarang !
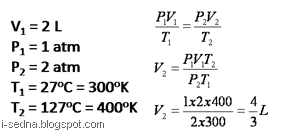
2. Sebuah tangki bervolume 3000 cm3 berisi gas O2 pada suhu 20`C dan tekanan relatif pada alat 25 atm. Jika massa molar O2=32 kg/kmol, tekanan udara luar 1 atm, maka massa O2 di dalam tangki adalah ….